加大監管力度,提高創新醫療器械的生產
國務院常務會決定再壓減工業產品生產許可證三分之一以上并簡化審批,為市場主體減負。在國新辦21日召開的國務院政策例行吹風會上,國家市場監管總局副局長田世宏進行了解讀。
利昂醫療的總工程師介紹,這次改革主要體現在4個方面:
一是大幅壓減許可證管理目錄。改革取消了14類產品,推動其中部分產品轉認證,下放了4類產品由省級部門實施。
二是推動“一企一證”改革。對繼續實施生產許可證管理的產品,按照“一企一證”的要求發證。凡是跨類別生產的企業,新申請許可證時,一并審查頒發一張證書;換發許可證時,將多種類別產品的許可合并到一張證書上。
三是著力調整產品檢驗和現場審查兩個關鍵環節。在全國范圍內,將發證前產品檢驗,改為由企業在申請時提交符合要求的產品檢驗合格報告,這樣也是節省時間,保證快速地發證書。除危險化學品外,對省級部門管理的產品實行后置現場審查,企業提交申請和產品檢驗報告,并作出保障質量承諾后,經形式審查合格即可取證,之后在規定時間內接受現場審查。
四是加大證后監管力度。對通過簡化程序取證的企業,加強企業“一單一書一照一報告”(即申請許可證需提交的申請單、承諾書、營業執照和產品檢驗合格報告)承諾公示,加強后置現場審查;對虛假承諾、不符合要求的,一律撤銷生產許可證;加強信用監管,運用信用激勵和約束手段,督促企業落實質量主體責任。
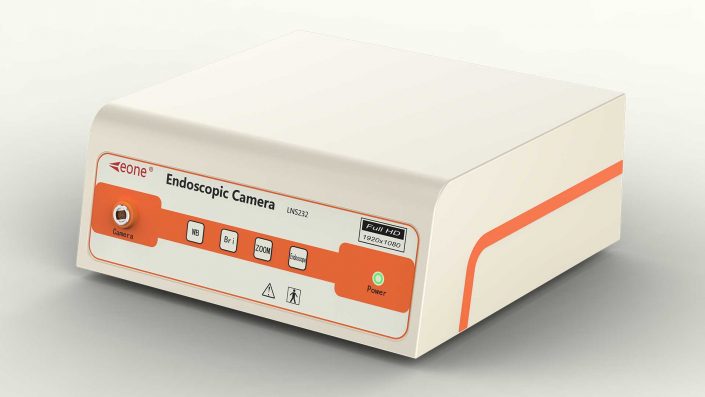
這點在醫療行業也是如此,加大監管力度,提高創新醫療器械的生產,多一些如南京利昂醫療的內窺鏡攝像機等的好的產品!
深化工業產品生產許可證制度改革,是推進放管服改革的重大措施之一。
近年來,為了進一步優化營商環境,適應市場經濟發展的需要,對生產許可證制度做了大量調整。在前期改革基礎上,著力壓減生產許可證管理目錄、著力簡化審批程序,營造更加公開透明便利的準入環境,進一步釋放市場和社會創造力。